Du kan bli bedt om å skrive den elektron konfigurasjon av et atom på en kjemi test, men det er enklere enn det ser ut. Her ser du hvordan du kommer i gang.
Trinn
- 1Bestem antall elektroner i atomet. Det atomiske tall (den på det periodiske system) er det antall protoner i atom, og således lik antall elektroner i et atom med null kostnad.
- 2Hvis du arbeider med et ladet atom, legge til eller trekke elektroner tilsvarende. For eksempel et natrium-atom med en negativ en belastning ville ha en annen elektron i tillegg til atomnummer 11, gjør 12 elektroner.
- 3Pugg den grunnleggende liste over orbitaler. Når du vet rekkefølgen av orbitaler, kan du bare fylle dem i henhold til antall elektroner i atomet.
- Den s orbital sett (et tall etterfulgt av en "s") inneholder en enkelt bane, og etter Paulis eksklusjon prinsippet kan en enkelt orbital inneholde maksimalt to elektroner, slik at hver s orbital sett kan holde to elektroner.
- Den p orbital settet inneholder 3 orbitaler, og således kan holde et totalt 6 elektroner.
- D orbital Settet inneholder fem orbitaler, slik at den kan romme 10 elektroner.
- F orbital Settet inneholder 7 orbitaler, så det kan holde 14 elektroner.
- Huske rekkefølgen av orbitaler. Merk at orbital sett er nummerert av elektron skall, men bestilte i form av energi. For eksempel, er en fylt 4s to lavere energi (eller mindre potensielt flyktig) enn en delvis fylt eller fylt 10 3d, slik at den 4s skallet er oppført først.
- 4Sett ett elektron inn i den høyeste energi orbital tilgjengelig, og starter med 1s (rommer maksimalt to elektroner).! Vær forsiktig Ikke fyll orbitaler i rekkefølgen som vist i figuren Fyll orbitaler i denne rekkefølgen (tallet etter orbital sett er det maksimale antall elektroner det kan holde):
- 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s to 5f 14 6d 10 7p 6
- Merk at listen ovenfor, hvis alle skjellene ble fylt, ville være den elektron konfigurasjon for Uuo (ununoctium), 118, den høyeste nummererte atom på den periodiske tabell - så dette elektron konfigurasjonen inneholder hver dag kjent elektron skall for et nøytralt ladet atom.
- Merk: Energi nivå endringer som du går opp. For eksempel, når du er i ferd med å gå opp til fjerde energi nivå, blir det 4s først, deretter 3d. Etter den fjerde energi nivå, vil du flytte inn på femte der den følger den rekkefølgen igjen. Dette skjer først etter at det tredje energinivået.
- 5Fyll i orbitaler i henhold til antallet av elektroner i atomet.
Alternativ metode
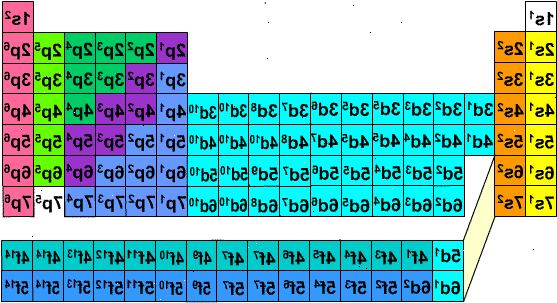
Det er en alternativ metode for å skrive elektron konfigurasjoner som krever verken Menneske, eller mnemonic diagrammet. Men, det krever omarrangert periodiske tabellen, fordi i tradisjonell periodiske tabell, som begynner med fjerde rad, trenger perioden antall ikke svarer til de elektron skjell.
I Adomah periodiske system, utformet av V. Tsimmerman, horisontale rekker representerer grupper av elementer, slik som halogener, inerte gasser, alkalimetaller, alkaliske jordarter, etc. Vertikale kolonner tilsvarer elektronskall og såkalte "overlapper" tilsvare perioder (når diagonale linjene som forbinder s, p, d og f blokker følges). Helium beveges til Hydrogen, siden begge er karakterisert ved de elektroner som befinner seg i den samme bane. Blokker av perioder (s, p, d og f) er vist på høyre side og shell tall vises på basen. Elementer er presentert i rektangulære bokser som er nummerert 1-120. Disse tallene er kalt atom-tall som også omfatter totale antall elektroner i et nøytralt atom. Denne ordningen gjør skriver elektron konfigurasjoner veldig enkelt:
- 1Skriv ut kopi av Adomah periodiske tabell fra denne nettsiden: ( www.perfectperiodictable.com/Images/Binder1 ). Å skrive elektron konfigurasjon av et element, finne sin symbol i Adomah Periodic Table og krysse ut alle elementer som har høyere atom-tall. For eksempel, hvis du trenger å skrive elektron konfigurasjon av Erbium (68), krysse ut elementer 69 gjennom 120. Legg merke til tallene 1 til 8 på undersiden av bordet. De er elektron skall numre eller kolonne tall. Ignorer kolonner som inneholder bare krysset ut elementer. For Erbium resterende kolonnene er 1,2,3,4,5 og 6.
- 2Ser på blokken symbolene som vises på høyre side av bordet (s, p, d, og f) og kolonnenumrene vist på basen og ignorerer diagonale linjer mellom blokkene, bryte opp kolonner i kolonne-blokker og liste dem i rekkefølge fra bunnen opp. Igjen, ignorere kolonnen blokker der alle elementer er krysset ut. Skriv ned kolonne-blokker som begynner med kolonnen etterfulgt av blokken symbol, slik som dette: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (i tilfelle av Erbium). Se note under. *
- 3Telle elementer som ikke var krysset ut i hver blokk-kolonne og skrive ned sine kvantitet ved siden av blokken symboler for hver blokk-kolonne, som her: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 12 5s 2 5p 6 6s to. Det vil si at den Erbium elektronkonfigurasjon av. (Se merknad nedenfor).
- 4Det er atten vanlige unntak elektron konfigurasjoner for atomer i den laveste energitilstand, også kalt grunntilstanden. De avviker fra den generelle regelen bare ved siste to til tre elektron stillinger. Her er de: Cr (..., 3D5, 4S1), Cu (..., 3d10, 4S1); Nb (..., 4d4, 5S1), Mo (..., 4d5, 5S1); Ru (..., 4d7, 5S1), Rh (..., 4d8, 5S1); Pd (..., 4D10, 5s0); Ag (..., 4D10, 5S1), La (..., 5D1, 6S2); Ce (..., 4f1, 5D1, 6S2); Gd (..., 4f7, 5D1, 6S2), Au (..., 5d10, 6S1), Ac (..., 6d1, 7s2); Th (..., 6d2, 7s2), Pa (..., 5F2, 6d1, 7s2), U (..., 5F3, 6d1, 7s2); Np (..., 5f4, 6d1, 7s2) og Cm (..., 5f7, 6d1, 7s2).
- Merk: Ovennevnte elektron konfigurasjon av Er er skrevet i størrelsesorden stigende shell tall. Det kan også bli skrevet på størrelsesorden orbital fylling. Bare følg kaskader fra topp til bunn i stedet for kolonner når du skriver ned kolonnen-blokker: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 12.
Tips
- Det er omstendigheter når et elektron må "forfremmet". Når en orbital sett er ett elektron bort fra å være en halv okkupert eller helt okkupert, fjerne ett elektron fra nærmeste s eller p orbital sett og flytte den til orbital sett som trenger elektronet.
- Når atomet er et ion, betyr det at det antall protoner ikke tilsvare antallet elektroner. Ansvaret for atom vil dem vises øverst til høyre (vanligvis) hjørne av kjemisk symbol. Så, har en antimon atom med kostnad 2 et elektron konfigurasjon av 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p en. Legg merke til at 5p 3 endret til et 5p en. Vær forsiktig når konfigurasjonen til en uladet atom ender i noe annet enn en s og p orbital sett. Når du tar bort elektroner, kan du bare ta dem bort fra Valence orbitaler (den s og p orbitaler). Så hvis en konfigurasjon ender i 4s 2 3d 7, og atomet får en kostnad på 2, deretter konfigurasjonen ville endre til slutt med 4s 0 3d 7. Legg merke til at 3d 7 ikke endrer seg, i stedet blir de s orbital elektroner tapt.
- Det finnes ikke noe slikt som "stabiliteten av en halv-fylt" undernivå. Det er en overforenkling. Enhver stabilitet i forbindelse med "halv-fylte" undernivåer skyldes det faktum at hver banes enkeltvis er opptatt, og dermed elektron-elektron repulsions minimaliseres.
- Du kan også skrive et element elektron konfigurasjon ved bare å skrive Valence konfigurasjon, som er den siste s og p orbital sett. Så ville Valence konfigurasjonen av en antimon atom være 5s 2 5p tre.
- For å finne atomnummer av atomet når det er i elektron konfigurasjon form, bare legge opp alle tallene som følger bokstavene (s, p, d, og f).
- Skriving lange elektron konfigurasjoner kan unngås ved å skrive dem i deres edelgass konfigurasjoner. Ved hjelp av et elektron konfigurasjon som er skrevet i størrelsesorden orbital fylling, finne det siste symbolet inneholder p6 (for eksempel 3p 6 eller 5p 6) og legge opp alle tallene etter bokstavene i hvert symbol før og med p6 orbital sett. Deretter, ved hjelp av summen av tallene, finner element med atomnummer lik summen du nettopp beregnet. Den skal ligge helt til høyre i det periodiske system. Det kalles en edelgass. Nå, bare fjerne alle symbolene som du har lagt opp og sette i edelgass 'symbol i parentes. Så, for en antimon atom, ville edelgass konfigurasjonen være [Kr] 5s 2 4d 10 5p tre. Legg merke til at du ikke legger opp 5s 2 og 4D 10 fordi de er etter 4p 6, som du legger til.
- Ioner er ikke de samme. De er mye hardere. Gå to nivåer og følger samme mønster avhengig av hvor du startet avhengig av hvor høyt eller lavt antall elektroner er.
- Hvert atom ønsker å være stabil, og de mest stabile konfigurasjoner har full s og p (S2 og P6) orbital sett. De edle gasser har denne konfigurasjonen, noe som er grunnen til at de er sjelden reaktive og er på den høyre side av det periodiske system. Så hvis en konfigurasjon ender i 3p 4, trenger den bare to elektroner for å bli stabil (miste seks, inkludert s orbital sett er elektroner, tar mer energi, så mister fire er lettere). Og hvis en konfigurasjon ender i 4d 3, må den bare for å miste tre elektroner for å nå en stabil tilstand. Også, halvveis fylt skall (S1, p3, D5..) er mer stabile deretter, for eksempel p4 eller p2, men vil S2 og p6 være enda mer stabil.
- Det er to forskjellige måter å skrive elektron konfigurasjoner. De kan skrives i størrelsesorden stigende shell tall, eller i størrelsesorden orbital fylling, som presentert ovenfor for Erbium.
- Tallet etter brevet er faktisk hevet, så ikke gjør det feil på en test.
