Grunnlaget for kjemi foregår på atomnivå. Kjemi er definert av hvordan individuelle atomer bånd med andre ulike atomer for å danne nye molekyler. Hvert atom har en kjerne av tettpakkede protoner og nøytroner, omgitt av et mer løst pakket sky av bane elektroner. Disse elektronene må holdes i sine baner av en kraft fra kjernen i atomet, og som også er utsatt for å bli revet bort av kraftigere kjerner som er introdusert inn i blandingen. Resultatet er et molekyl som har egenskaper som er forskjellige fra de av de bærende atomene. Elektronegativitet er grunnleggende for denne prosessen. Elektronegativitet er kraften av et atom i et molekyl å tiltrekke seg elektroner til seg selv. Bruk disse tipsene for å lære hvordan man skal beregne elektronegativitet.
Trinn
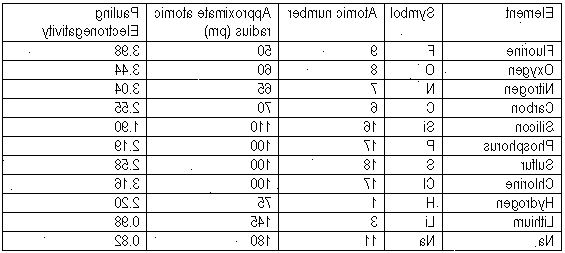
- 1Få tilgang til en periodisk tabell. Finn en periodisk tabell som viser elementene og sitt eget elektronegativitet. Disse kan bli funnet i en rekke kjemiske lærebøker og tekniske artikler. Atomic eiendommer oppført i denne artikkelen som vil være nødvendig for de beregningene som er beskrevet i denne artikkelen kan bli funnet i kjemiske lærebøker og tekniske artikler.
- 2Forstå problemet. Forstå at elektronegativitet ikke kan beregnes nøyaktig. Det kan utledes fra de reaksjonene som skjer når atomer binder sammen og danner molekyler. Listen på den periodiske tabellen som du har fått er avledet fra måling av disse molekyl forming reaksjoner. Beregningene er oppført senere i denne artikkelen er akseptert som bare omtrentlige spådommer.
- 3Slå opp elektronegativitet av en av de to atomene som er involvert i en molekylær binding. Den Pauling metode har en ulempe ved at den beregner differansen i elektronegativitet mellom to atomer som er støpt fast. Derfor må elektronegativitet av en av atomene være kjent for å beregne elektronegativitet av den andre atom.
- 4Figur den forventede bindingsstyrke av en to-atom molekylet. Legg liming energier av de to atomer og dividere med to.
- 5Slå opp den målte bindstyrke av 2-atom-molekylet. Dette vil være forskjellig fra det beregnede forventede bindestyrke.
- 6Beregn forskjell i elektronegativitet av de to atomer. Subtraher den forventede bindingsstyrke av molekylet fra den målte styrke bindingen av molekylet. Ta kvadratroten av resultatet. Dette resultatet vil være forskjellen i elektronegativitet av de to atomer.
- 7Figur den elektronegativitet av det ønskede atom. Den elektronegativitet av det ønskede atom blir elektronegativitet av den kjente atomet pluss eller minus differansen beregnet, som er nødvendig for å balansere formelen.
Finn Milliken elektronegativitet
- 1Løs Millikens elektronegativitet ligningen. Legg ioniseringsenergien av atomet av interesse for den elektron affiniteten til atomet av interesse. Dele summen innhentet av to. Dette gir den Milliken elektronegativitet av atomet av interesse.
Bestem sanderson elektronegativitet
- 1Figur elektrontettheten. Elektrontettheten av atomet av interesse er atomnummeret dividert med den atomære volum. Atomforholdet volum av atomet av interesse er den tredje potens av den kovalente radius på atomet.
- 2Finn sanderson elektronegativitet. Fordel elektrontettheten av atomet av interesse ved den forventede elektrontettheten av dette atomet. Resultatet er Sanderson elektronegativitet av atomet.
Ting du trenger
- Periodiske tabellen av elementene
