Før mose eller baking og spise de deilige poteter i kveld, hva med å bruke dem til å lære litt om kjemiske reaksjoner først? Du kan gjøre dette gjennom å bygge en klokke som går utelukkende på poteter. Gi den en gå før guffawing!
Trinn
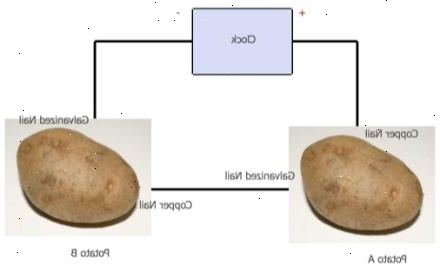
- 1Monter elementene som kreves. Disse er listet opp nedenfor under "hva du trenger".
- 2Skille de to poteter. Hver potet fungerer som en "galvanisk celle", slipper elektrisk energi gjennom kjemiske reaksjoner. Ring en potet A (eller 1), og den andre potet B (eller 2).
- Hovedtyngden av poteten fungerer akkurat som en sak for cellen, holder alt på plass. Den potetsaften tjener som "elektrolytt", der ladede atomer og molekyler som kalles "ioner" oppløses og kan strømme over tid. Den fortynnet fosforsyre i det gir også hydrogenioner for reaksjonen.
- Noen atomer (eller molekyler) sterkt tiltrekke ekstra elektroner og bli negativt ladede ioner, kalt løk ("an-ioner"), andre blir lett strippet for noen elektroner og bli positivt ladet "kasjoner" ("cat-ioner"). Hvert element tiltrekker elektroner med forskjellig kraft, på grunn av ulik kostnad av protoner med som sin kjerne tiltrekker elektroner og på hvilken måte de marginale "Valenselektronene" elektroner ordne seg selv rundt kjernen og andre elektroner.. Poteten juice har fortynnet fosforsyre, noen som løser opp skilt inn som hydrogen kasjoner (i utgangspunktet) og fosfat anioner.
- 3Plasser en galvanisert spiker i hver potet.
- 4Plasser en spiker eller wire stykke inn i hver potet sikre at neglene ikke berører hverandre. På dette stadiet er det veldig viktig å forstå at dette eksperimentet vil fungere bare hvis de galvanisert spiker og kobber spiker / wire er så langt fra hverandre som mulig på poteten fordi avstanden mellom dem er det som genererer strøm.
- 5Ta av batterilokket fra klokken. Hvis det allerede er et batteri i den, fjern det. Ta notis av batteriets polaritet i forhold til hvordan den kobles til klokken.
- 6Koble den første jumper wire fra kobber spiker eller wire av potet A til plusspolen på klokken. For å gjøre dette, ta en jumper bly og fest alligator klipp til kobber spiker eller wire og deretter den andre enden er alligator klipp til den positive terminalen (merket med symbolet +).
- 7Koble den andre jumper wire fra galvanisert spiker av potet B til minuspolen på klokken, merket med symbolet "-".
- Når du holder sinken elektrode (plating på den galvaniserte spiker) og kobber-elektrode (kobber spiker eller wire) i potet, hvert metall, som har mindre affinitet enn elektron de hydrogenioner, vil en tendens til å få atomer strippet for sine elektroner fra hydrogen ioner. De nøytrale hydrogenatomer ville bli sammen til hydrogen gass molekyler og rømme, de metallkationene ville tendens til å spre seg bort og mer hydrogen diffuse i å fortsette reaksjonen sakte bobler bort syren er hydrogen og forbruker metaller.
- Sink har enda mindre elektron affinitet enn kobber. Så, hvis du kobler elektrodene med en dirigent, ledningen, vil noen elektroner en tendens til å flyte i det fra sink til kobber.
- Fjerning av noen elektroner fra sink elektrode vil gjøre noen av sine atomer falle av som kationer og bli oppløst unna. Det overskudd av elektroner på kobber vil gjøre hydrogen preferensielt ta dem opp der, men også har en tendens til å gjøre kobber beholde sine elektroner og ikke være korrodert (eller mer presist, forskyve likevekten slik at kobberioner som faller av tendens å gjenvinne elektroner og fest for liten eller ingen netto korrosjon). Fjerningen av elektroner fra kobber og tilsetning av elektroner til den sink ville har tendens til å bygge opp områder av elektrisk ladning som ville forsinke reaksjonen. Men mer elektroner holde gjennomføring gjennom ledningen, og hydrogen-og sinkioner holde dispergering gjennom potet å opprettholde frisk løsning ved hver elektrode, for å holde reaksjonen i gang. Den kraft med hvilken kobber således trekker elektronene kan brukes til å utføre arbeid, som driver en klokke..
- 8Koble den tredje jumper wire til galvanisert spiker av potet A. Deretter kobler den andre enden til kobber spiker av potet B. Ved dette stadiet alle tre startkabler fører henger sammen, og klokken skal fungere.
- 9Se på klokken. Det skal nå kjøre på potet makt.
- Reaksjonen bremser som sinkmetall og hydrogen-ionene blir tømt. Den kraften som hydrogen trakk elektronene av sink, i en svært rundkjøring måte, er hva cellen gjør tilgjengelig for deg for arbeid - med litt blir "bortkastet", selvfølgelig.
- Kabling potet celler ende-til-ende gjør en "serie krets", trekke strøm av elektroner gjennom døgnet med dobbelt så mye kraft som en potet ville gjelde. Det gjør dem også riktig kalt en "batteri", fordi du bruker mer enn én elektrokjemisk "celle".
- Når det fungerer, hvorfor ikke stille klokken på klokken til gjeldende tid!
- Hvis klokken ikke virker, sjekk at alle tilkoblinger er sikre og i riktig rekkefølge, og dobbeltsjekke polariteten av klokken. Hvis det fortsatt ikke fungerer, kan det hende at klokke krever mer strøm enn det svært lite en grønnsak batteri kan gi. Du kan forvisse deg om at batteriet er å produsere noen elektrisitet med og måle dens spenning (elektrisk trykk) og strøm (elektrisk strøm, forsterkere). Hvis du har å velge vekter, velger svært lave seg: disse batteriene produsere en volt eller to og noen få milliampere.
Tips
- Du kan kjøpe en potet klokke kit. Billigere de bare har en klokke som plugges inn i potetene med ledninger og elektroder; dyrere holde potetene i en integrert montering med kopper.
- Det er ikke bare poteter du kan gjøre dette med. Prøv andre frukter og grønnsaker, som for eksempel sitrus, avokado, bananer, etc. Det vil også arbeide i brus.
- Israelske forskere har funnet ut at de kan produsere opp til 10 ganger så mye effekt når poteten er kokt.
- En sitron batteri arbeider omtrent på samme måte, men med sitronsyre i stedet for fosforsyre gi hydrogenioner. Andre typer batterier tilsvarende tillate deg å utnytte energien av elektronenes flyt fra et område hvor de er lettere gitt opp til der de blir lettere akseptert, men skiller seg på mange detaljer.
- Fenomenet de ekstra elektroner som holder kobber korroderer kan være nyttig, også. Hvis det er målet ditt, du sa til å bruke "katodisk beskyttelse" heller enn å gjøre et batteri. En billig del av reaktivt metall, slik som sink eller magnesium, kan korrodere seg bort og etterfylle elektroner for å beskytte en verdifull struktur av mindre-reaktivt metall, som en bro eller et skip. (Vann er ikke på langt nær så reaktivt som batterisyre, slik det reaktive metall varer en stund, selv med ingen motstand mot strømmen i lederen.) For en stor struktur, kunne man bruke likestrøm "påtrykt strøm" fra en on -site generator eller linje effekt (med en profesjonelt utformet maskin - strøm og vann kan være farlig).
- Klokken er trolig en klokke, som gjelder strøm til en liten kvarts-krystall stemmegaffel å fysisk "ring" den på sitt resonansfrekvensen. Gaffelen gir tilbake et elektrisk signal med hver vibrasjon. Andre deler elektronisk telle vibrasjoner, beregne den tilsvarende tid, og ordne krystallene i skjermen for å vise det fram.
Advarsler
- Små barn bør være under oppsyn når du utfører dette eksperimentet - negler og ledninger er skarpe og kan forårsake skade ved feil håndtering. Fjerning av batterier bør også være under oppsyn.
- Ikke spis potetene etterpå.
Ting du trenger
- 2 store rene poteter eller to halvdeler av en stor potet.
- 2 galvanisert spiker (sink)
- 2 kobber spiker eller ledninger
- 3 genser ledninger (med krokodilleklemmer i hver ende)
- Batteridrevet LCD klokke (grå skjerm med sorte tall, som en billig klokke, normalt tar bare ett 1.5V batteri)
