Bestemme antall nøytroner i et atom er egentlig ganske enkel og ikke engang krever noe eksperimentering. For å beregne antall nøytroner i en vanlig atom eller en isotop, følg disse instruksjonene.
Trinn
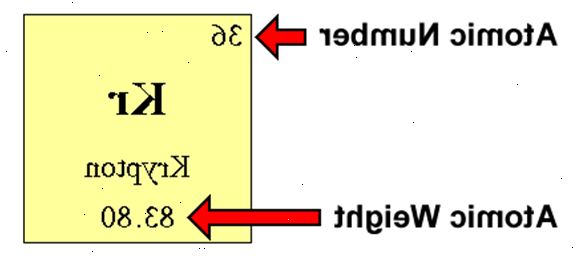
Nøytroner i en vanlig atom
- 1Lokaliser element på det periodiske system. For dette eksempelet, vil vi se på osmium (Os), som er i den sjette rad ned.
- 2Finn elementets atomnummer. Dette har en tendens til å være den mest synlige tall knyttet til et gitt element, og vanligvis ligger over elementet symbol. (På vårt eksempel diagram, faktisk, er ingen andre tall oppført.) Den atomnummer er antall protoner i et enkelt atom av dette elementet. Os er nummer 76, som betyr ett atom av osmium har 76 protoner.
- 3Finn elementets atomvekt. Dette tallet er vanligvis funnet under atomic symbol. (Merk at figuren i dette eksemplet er basert utelukkende på atomnummer og viser ikke atomvekt. Dette vil vanligvis ikke være tilfelle.) Osmium har en atomvekt på 190,23.
- 4Rund av atomvekt til nærmeste hele tall for å finne den atomic masse. I vårt eksempel, ville 190,23 bli avrundet til 190, noe som resulterer i en atom massen av 190 for osmium.
- 5Trekk atomnummer fra atomic masse. Siden de aller fleste av en atom massen er funnet sine protoner og nøytroner, trekke fra antall protoner (dvs. atomnummer) fra atom-masse vil gi deg den beregnede antall nøytroner i atomet. I vårt eksempel er dette: 190 (atomvekt) - 76 (antall protoner) = 114 (antall nøytroner).
- 6Husk formelen. For å finne antall nøytroner i fremtiden, kan du bruke denne formelen:
- N = M - N
- N = antall N eutrons
- M = atomic M ass
- n = atomic n umbra
- N = M - N
Nøytroner i en isotop
- 1Lokaliser element på det periodiske system. Som et eksempel vil vi se på karbon-14 isotopen. Siden de ikke-isotopisk form av karbon-14 er ganske enkelt karbon (C), finner karbon på den periodiske tabellen (i den andre raden ned).
- 2Finn elementets atomnummer. Dette har en tendens til å være den mest synlige tall knyttet til et gitt element, og vanligvis ligger over elementet symbol. (På vårt eksempel diagram, faktisk, er ingen andre tall oppført.) Den atomnummer er antall protoner i et enkelt atom av dette elementet. C er nummer seks, som betyr ett atom karbon har 6 protoner.
- 3Finn atomic masse. Dette er utrolig enkelt med isotoper, som de er navngitt i henhold til deres atom-masse. Karbon-14, for eksempel, har en atommasse av 14 år.
- 4Trekk atomnummer fra atomic masse. Siden de aller fleste av en atom massen er funnet sine protoner og nøytroner, trekke fra antall protoner (dvs. atomnummer) fra atom-masse vil gi deg den beregnede antall nøytroner i atomet. I vårt eksempel er dette: 14 (atomic mass) - 6 (antall protoner) = 8 (antall nøytroner).
- 5Husk formelen. For å finne antall nøytroner i fremtiden, kan du bruke denne formelen:
- N = M - N
- N = antall N eutrons
- M = atomic M ass
- n = atomic n umbra
- N = M - N
Tips
- Protoner og nøytroner utgjør nesten hele vekten av elementene, mens elektroner og forskjellige partikler representerer ubetydelig masse (nærmer seg null masse). Siden ett proton har omtrent samme vekt som en nøytron, og atom-tallet representerer antall protoner, kan vi bare trekker det antall protoner fra den totale massen.
- Osmium, et metall som er fast ved romtemperatur, navnet stammer fra det greske ordet for lukt, "osme."
- Hvis du er usikker hvilket nummer som er i en periodisk tabell, bare husk at tabellen er vanligvis designet rundt atomnummer (dvs. antall protoner), som starter på 1 (hydrogen) og stiger én enhet om gangen fra venstre til høyre, og endte på 118 (ununoctium). Dette er på grunn av antall protoner i et atom avgjør hva som atomet, og er den enkleste elementært egenskap å organisere ved. (Eks. et atom med to protoner er alltid helium, akkurat som et atom med 79 protoner er alltid gull.)
